Свинцово-сульфатные батареи - это более традиционные вторичные аккумуляторы, широко используемые в различных областях, например, в качестве стартовых батарей для автомобилей, источников бесперебойного питания (ИБП), электромобилей и резервных источников энергии для энергосистем. Понимание принципа работы свинцово-сульфатных батарей важно для обслуживания, оптимального использования и выбора правильного типа батареи. В этой статье мы всесторонне и подробно рассмотрим принцип работы свинцово-сульфатных батарей, проведем глубокий анализ состава, процесса зарядки и разрядки и так далее.
Основные компоненты свинцово-сульфатной батареи включают положительный электрод, отрицательный электрод, электролит, сепаратор и корпус батареи. Положительный электрод в основном состоит из диоксида свинца (PbO2), коричневато-черного цвета; отрицательный электрод состоит из губчатого свинца (Pb); электролит представляет собой разбавленный раствор серной кислоты (H2SO4); сепаратор обычно изготавливается из непроводящего микропористого материала, который предназначен для предотвращения прямого контакта положительного и отрицательного электродов от короткого замыкания, и в то же время позволяет ионам в электролите свободно проходить через корпус батареи обычно изготавливается из кислотостойкого пластика или других непроводящих материалов для обеспечения механической прочности и герметичности. материалы для обеспечения механической прочности и герметичности. Среди этих основных компонентов концентрация электролита, температура и качество положительных и отрицательных материалов будут напрямую влиять на производительность и срок службы батареи.
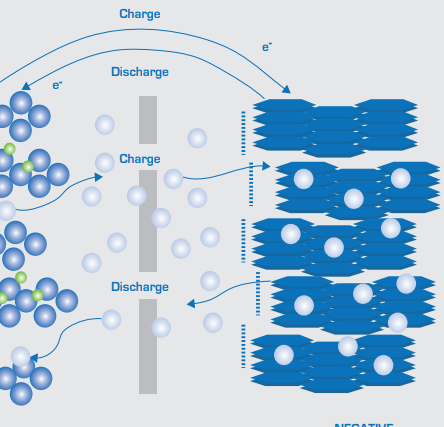
Разряд батареи - это процесс химической реакции, в ходе которой химическая энергия преобразуется в электрическую энергию. При разряде диоксид свинца на положительном электроде реагирует с серной кислотой в электролите, образуя сульфат свинца (PbSO4) и воду (H2O). В то же время губчатый свинец на отрицательном электроде также реагирует с серной кислотой с образованием сульфата свинца и воды, при этом образующаяся вода способна разбавлять электролит, что приводит к снижению концентрации электролита. Химическое уравнение реакции разряда можно выразить следующим образом:
Отрицательная реакция: Pb + HSO4- → PbSO4 + H+ + 2e-
Положительная реакция: PbO2 + HSO4- + 3H+ + 2e- → PbSO4 + 2H2O
Общая реакция: Pb + PbO2 + 2H2SO4 → 2PbSO4 + 2H2O
В процессе разряда из-за реакции диоксида свинца и губчатого свинца образуется тот же сульфат свинца, что приведет к постепенному уменьшению активного вещества положительного и отрицательного электродов, и разрядная емкость батареи уменьшается, пока в батарее не закончится активное вещество, и разряд батареи не закончится. Электроны, высвободившиеся между полюсами батареи, проходят через внешнюю цепь и поступают в устройства, которым требуется электричество.
Процесс зарядки по сути является обратной реакцией процесса разрядки, т. е. при подаче внешнего напряжения на аккумулятор ток вынужден течь в обратном направлении, чтобы вновь преобразовать химическую энергию. Во время зарядки на положительном электроде происходит реакция восстановления, в результате которой сульфат свинца превращается в диоксид свинца, а на отрицательном электроде происходит реакция окисления, в результате которой сульфат свинца превращается в губчатый свинец и образуется серная кислота. Химическое уравнение реакции заряда противоположно реакции разряда:
Отрицательная реакция: PbSO4 + H+ + 2e- → Pb + HSO4-
Положительная реакция: PbSO4 + 2H2O → PbO2 + HSO4- + 3H+ + 2e-
Общая реакция: 2PbSO4 + 2H2O → Pb + PbO2 + 2H2SO4
Во время зарядки химическая структура батареи восстанавливается, и батарея реактивируется, поскольку сульфат свинца преобразуется обратно в исходные положительные и отрицательные материалы. По мере зарядки концентрация серной кислоты в электролите постепенно увеличивается, внутреннее сопротивление батареи начинает падать, и емкость батареи постепенно восстанавливается. Как правило, для полного завершения реакции заряда батарею необходимо заряжать выше номинального напряжения, чтобы обеспечить ее полную зарядку, а также контролировать скорость заряда, чтобы предотвратить перегрев электролита, коррозию положительного электрода или гидролиз с выделением кислорода и водорода, что приводит к проблемам безопасности.
Стоит отметить, что в процессе зарядки и разрядки свинцово-сульфатные батареи будут производить определенную степень потери энергии, эта потеря в основном в виде рассеивания тепла, в то время как электролиз воды в электролите приведет к изменению концентрации электролита. Поэтому правильное обслуживание батареи и своевременное восполнение воды, потерянной в результате испарения, является важной мерой для обеспечения нормальной работы батареи и продления срока ее службы.
В целом, принцип работы свинцово-сульфатного аккумулятора заключается в преобразовании химической энергии в электрическую для разряда посредством химической реакции между положительным и отрицательным электродами, и в обратной реакции для заряда посредством приложенного напряжения. Четкий анализ структурного состава, процессов разряда и заряда поможет нам лучше понять и использовать этот классический тип аккумулятора.